ゼラチンはコラーゲンを親物質とする動物性タンパク質です。「ゼラチンの製造法」からもわかるように、様々な精製工程を経ているため、タンパク質以外の物質は少なくなります。
|
タンパク質 |
85%以上 |
|---|
|
水分 |
8~14% |
|---|
|
灰分 |
2% |
|---|
|
その他(脂質、多糖類) |
1%以下 |
|---|
ゼラチンはコラーゲンの熱変性物質であるため、そのアミノ酸組成はコラーゲンとほぼ同じです。AタイプとBタイプでは、Bタイプの方が若干オキシプロリンが多く、逆にチロシンは少ない傾向にあります。豚皮および牛皮、牛骨ゼラチンのアミノ酸組成の一例を<表5-2>に示します。魚鱗ゼラチンは牛・豚ゼラチンに比べてオキシプロリンは少ない傾向にあります。
ゼラチン・コラーゲンのアミノ酸組成および配列は、他のタンパク質と比較して非常に特異的です。グリシンが全体の約3分の1を占め、アミノ酸配列では3個に1個の繰り返しとなっています。グリシンは最も簡単なアミノ酸であり、分子鎖の配置への束縛も少なく、ゲル化に際してのヘリックス構造の再生に大きく寄与します。イミノ酸(プロリン、オキシプロリン)も多く含まれ、全体の約9分の2を占めます。イミノ酸はピロリジン環をもち、グリシンとは逆に分子鎖の配置への束縛が大きく、ヘリックス構造の安定化に寄与しています。必須アミノ酸を見てみると、リジンが比較的多いのに対して、トリプトファンは含有量がゼロで、制限アミノ酸となっています。

|
注)略号で*印は必須アミノ酸
ゼラチンのアミノ酸組成で、側鎖に極性基をもつアミノ酸の割合は約35%あり、その内訳は水酸基15%、酸性基12%、塩基性基8%。酸性基をもつグルタミン酸、アスパラギン酸は、コラーゲン中では約3分の1がアミド化されています。そのため、コラーゲンの等イオン点は、pH9~9.2です。
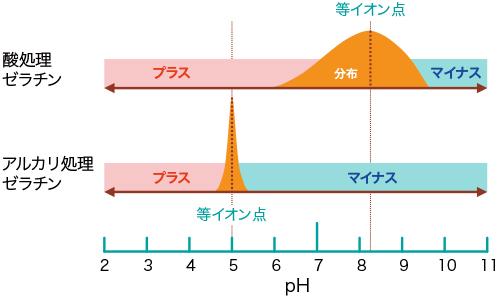
しかし、ゼラチンの製造工程中に、コラーゲン中の酸アミドは加水分解され、アンモニアを遊離してカルボキシル基に変化するので、ゼラチンの等イオン点は低下していきます。特にアルカリ処理ゼラチンは、石灰漬工程で100%近く脱アミドされているため、等イオン点はほぼpH5です。これに対し、酸処理ゼラチンでは、原料処理期間が短く、脱アミド率が低いので、等イオン点はコラーゲンに近いpH8~9です。
<図5-3>に、両タイプゼラチンの等イオン点と等イオン点分布を記載します。酸処理ゼラチンは、前述のような理由で、アミノ酸側鎖の脱アミド率が低く、また分子ごとの脱アミド程度も異なるため、等イオン点が高いだけでなく、等イオン点分布もブロードです。これに対し、アルカリ処理ゼラチンの等イオン点はシャープな分布になっています。ゼラチン水溶液は等イオン点より低pH側で+(プラス)、高pH側では-(マイナス)に荷電。このように、等イオン点を境にしてゼラチン分子の荷電状態が変わるため、系のpHによっては、粘度が変動したり、反対荷電の電解質との共存で濁りが発生することがありますので注意が必要です[12-6. ゼリーのにごり参照]。
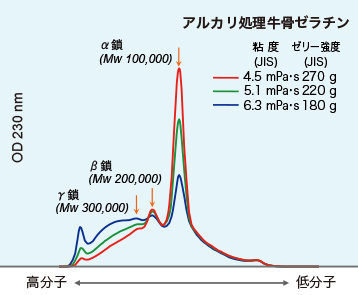
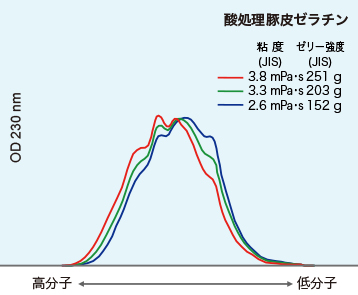
「ゼラチンの原料」で述べたように、コラーゲンは約10万の分子量をもつ3本のポリペプチド鎖(α鎖)で構成されています。コラーゲン分子が加熱処理によって変性すると、3本のα鎖に分かれますが、実際のゼラチン製造では、それ以外にα鎖の2量体(β成分)と3量体(γ成分)も生成しています。また、原料処理や工程中の熱履歴によって、コラーゲン、ゼラチンの分子間、分子内結合の一部もランダムに切断されるため、ゼラチンは種々の分子量を持つ分子の集合体になっています。通常、市販ゼラチンは、数万~数百万の分子量分布をもっています。
<図5-4-1>に、GPC(ゲル浸透クロマトグラフィー/PAGI法)によるアルカリ処理骨ゼラチンの分子量分布の一例を記載します。顕著なピークが、分子量約10万のα成分です。α、β、γ成分、高分子量および低分子量成分の比率や分子量分布のパターンは、ゼラチンメーカーの製造履歴やゼラチンのタイプ、グレードを反映して、様々に変化します。
ゼラチンは脂肪分など、その他の物質をほとんど含まない純粋な動物性タンパク質です。しかし、グリシンやイミノ酸が非常に多い反面、シスチンやトリプトファンを含まないという特殊なアミノ酸組成になっています。特に、必須アミノ酸であるトリプトファンが欠けているため、ゼラチンのタンパク価はゼロ。この意味で、ゼラチンは完全栄養食品ではないですが、他のタンパク質に不足する必須アミノ酸供給源として活用することで、食品としてより有効に働きます。例えば、ゼラチンにはリジンが比較的多く含まれているので、リジンが制限アミノ酸になっている米や小麦粉とゼラチンを合わせて摂取することで、栄養補足効果があらわれます。
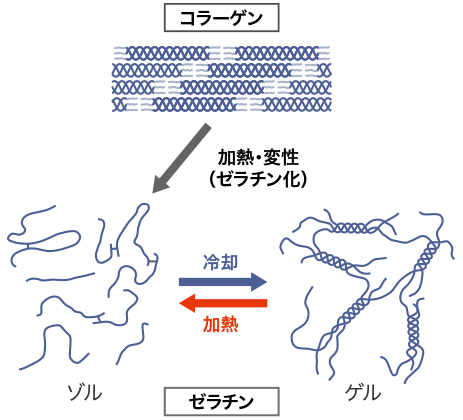
ゼラチンの最大の特徴は、加熱・冷却によって、ゼラチン溶液がゾルからゲル、ゲルからゾルに相変化し、しかもこのゾル-ゲル変化を常温に近い温度で可逆的に行なえることです。コラーゲンの熱変性物であるゼラチンは、加熱溶液ではランダムコイル状の分子構造をとっています。この溶液を冷却すると、ゼラチン分子の一部が、もとのコラーゲン様のらせん構造をとり、ネットワークが形成される結果、最終的に流動性を失い、ゲル化します。このゲルネットワークは、冷却を続けると時間と共に増加し、より強固なゲルを形成します。<図5-6>に、ゾル-ゲル変化の模式図を示します。
ゼラチンゲルの強さは、一般的にJIS規格(JIS K6503)に定められた「ゼリー強度」で表現されます。ゼリー強度測定は、6.67%のゼラチン溶液を10℃で17時間冷却して調製されたゲルの表面を、2分の1インチ径のプランジャーで加重。ゲル面を4ミリ押し下げるのに必要な重量を計測することによって計測され、単位はグラムで表現されます。
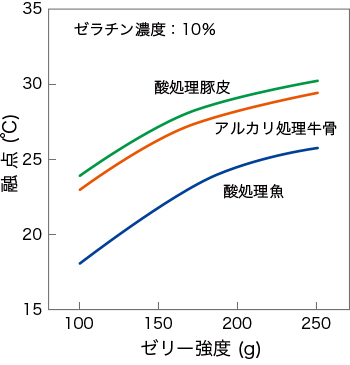
ゼラチンゾル(水溶液)を冷却するとゲル(ゼリー)化し、ゲルを加熱するとゾル(水溶液)になります。このゲル化する温度を凝固点、ゾル化する温度を融点といいます。ゼラチンの融点・凝固点は、他のゲル化剤と比べて低くく、牛・豚由来のゼラチンの融点は23~30℃。ゼラチンの種類や添加量、配合によっても異なります。特に、魚由来のゼラチンは融点が低い傾向にあり、これは含有するヒドロキシプロリン量が低いことに起因すると考えられており、融点と凝固点の差は約5℃です。また、糖類により固形分を増加させると融点・凝固点は上昇する傾向にあります。
ゼラチンは過度の加熱や紫外線、ガンマ線の照射やある種の物質との反応によって水に不溶解になります。
ゼラチンを不溶化させる物質を架橋剤(硬化剤)といい、無機化合物ではクロム、アルミニウム、第二鉄などの多価金属イオンを含む塩、また有機化合物ではアルデヒド類、ケトン類、キノン類などが代表的です。反応性について見ると、無機化合物の場合は、ゼラチンのカルボキシル基がその反応に関与しているため、pH4.5付近の反応性が高くなります。有機化合物とは、pH8付近の反応性が高く、これにはアミノ基が関与しています。また、ポリフェノール類、カテキン、魚油などの食品材料として利用される物質の中にもゼラチンと反応するものがあります。
アミノ酸と糖の混合物に熱をかけると、メイラード反応(アミノカルボニル反応)によって褐色に変化することは良く知られていますが、ゼラチンの場合も、ブドウ糖のようなカルボニル基を含む糖との共存下で、高温の加熱や長期間の保存により、着色したり、不溶化します。メイラード反応に影響を及ぼす因子として、糖の還元能、pH、温度、共存金属イオンなどが挙げられます。


